Masing-masing subkulit memiliki jumlah orbital dan daya tampung yang berlainan menyerupai berikut :
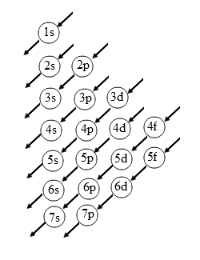
- Tentukan konfigurasi elektron atom Na (no atom = 11).
Pembahasan :11Na : 2 8 1 : 1s2 2s22p6 3s1
-
Tentukan konfigurasi elektron sebuah elemen yang memiliki nomor atom 13 dan nyatakan dalam konfigurasi [Ne]. (Nomor atom Ne = 10).Pembahasan :
10Ne : 2 8 : 1s2 2s2 2p6
13X : 2 8 3 : 1s2 2s2 2p6 3s2 3p1 : [Ne] 3s2 3p1
Satu hal penting yang mesti diamati merupakan pada pengisian elektron , subkulit d akan condong berisi 10 elektron (penuh) atau 5 elektron (setengah penuh) sehingga berlaku :
Unsur-unsur kelompok IA
zX : K L M N O P : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s
1H : 1 : 1s1
3Li : 2 1 : 1s2 2s1
11Na : 2 8 1 : 1s2 2s22p6 3s1
19K : 2 8 8 1 : 1s2 2s22p6 3s23p6 4s1
37Rb : 2 8 18 8 1 : 1s2 2s22p6 3s23p6 4s23d104p6 5s1
55Cs : 2 8 18 18 8 1 : 1s2 2s22p6 3s23p6 4s23d104p6 5s24d105p6 6s1
Unsur-unsur kelompok IIA
zX : K L M N O P : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s
4Be : 2 2 : 1s2 2s2
12Mg : 2 8 2 : 1s2 2s22p63s2
20Ca : 2 8 8 2 : 1s2 2s22p63s23p6 4s2
38Sr : 2 818 8 2 : 1s2 2s22p63s23p6 4s23d104p6 5s2
56Ba : 2 818 18 8 2 : 1s22s22p63s23p64s23d104p65s24d105p6 6s2
zX : K L M N O : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p
5B : 2 3 : 1s2 2s2
13Al : 2 8 3 : 1s22s22p63s23p1
31Ga : 2 8 18 3 : 1s22s22p63s23p6 4s2 3d104p1
49In : 2 818 18 3 : 1s2 2s22p6 3s23p6 4s23d104p6 5s24d105p1
Unsur-unsur kelompok IVA
zX : K L M N O : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p
6C : 2 4 : 1s2 2s22p2
14Si : 2 8 4 : 1s2 2s22p63s23p2
32Ge : 2 8 18 4 : 1s2 2s22p63s23p6 4s23d104p2
50Sn : 2 8 18 18 4 : 1s2 2s22p63s23p64s23d104p65s24d105p2
Unsur-unsur kelompok VA
zX : K L M N O : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p
7N : 2 5 : 1s2 2s22p3
15P : 2 8 5 : 1s22s22p63s23p3
33As : 2 8 18 5 : 1s2 2s22p63s23p6 4s23d104p3
51Sb : 2 8 18 18 5 : 1s2 2s22p63s23p64s23d104p65s24d105p3
Unsur-unsur kelompok VIA
zX : K L M N O : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p
8O : 2 6 : 1s2 2s22p4
16S : 2 8 6 : 1s22s22p63s23p4
34Se : 2 8 18 6 : 1s2 2s22p63s23p6 4s23d104p4
52Te : 2 8 18 18 6 : 1s2 2s22p63s23p64s23d104p65s24d105p4
Unsur-unsur kelompok VIIA
zX : K L M N O : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p
9F : 2 7 : 1s2 2s22p5
17Cl : 2 8 7 :1s2 2s22p63s73p5
35Br : 2 8 18 7 : 1s2 2s22p6 3s23p6 4s23d104p5
53I : 2 8 18 18 7 : 1s22s22p63s23p64s23d104p65s24d105p5
Unsur-unsur kelompok VIIIA
zX : K L M N O : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p
2He : 2 : 1s2
10Ne : 2 8 :1s2 2s22p6
18Ar : 2 8 8 : 1s2 2s22p63s23p6
36Kr : 2 8 18 8 :1s2 2s22p63s23p6 4s23d104p6
54Xe : 2 818 18 8 : 1s2 2s22p63s23p6 4s23d104p6 5s24d105p6


